Учёные открыли 100-% эффективный метод преобразования углекислого газа в топливо и химреактивы
Учёные придумали множество реакций по превращению углекислого газа в топливо или химреактивы, но все они имеют недостатки и далеки от 100-% эффективности. Такие реакции ведут к побочным продуктам в виде водорода или карбонатов и зря расходуют энергию. Но учёные из США придумали техпроцесс, в ходе которого происходит абсолютно эффективное преобразование CO2 в топливо или химические реактивы с использованием дешёвого цинкового катализатора, что меняет всё.
Источник изображения: Nature
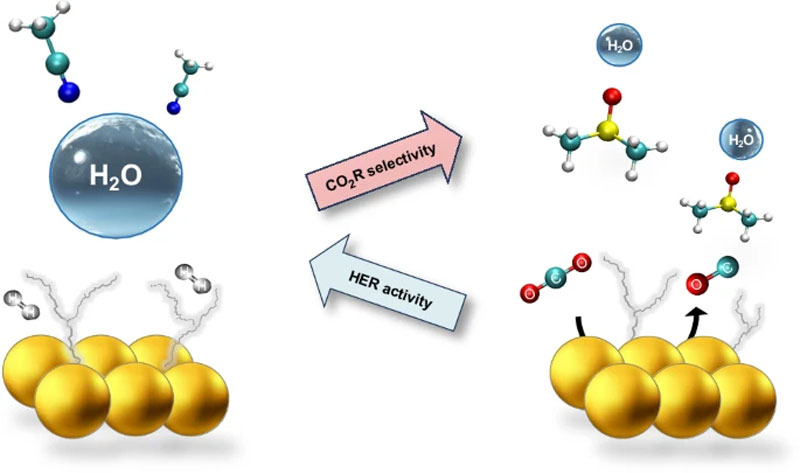
Открытие сделали исследователи из Школы молекулярной инженерии Притцкера Чикагского университета (UChicago Pritzker School of Molecular Engineering). Рецензируемая публикация по работе вышла в журнале Nature. Учёные поставили перед собой цель создать условия для высочайшего контроля молекул воды в растворе, чтобы каждый протон в электрохимическом процессе преобразования CO2 во что-то полезное расходовался не на пустышки типа образования газообразного водорода или карбонатов, а вовлекался в синтез синтетического топлива или химических реактивов: этанола, метилового спирта, муравьиной кислоты и других соединений.
«Представьте, что мы можем получать экологически чистое электричество от солнца и ветра, а затем использовать это электричество для преобразования любого углекислого газа обратно в топливо», — поделился своей мечтой первый автор статьи Реджи Гомес (Reggie Gomes).
Исследователи не стали изобретать велосипед, а воспользовались хорошо известной реакцией электрохимического восстановления диоксида углерода (CO2R, electrochemical carbon dioxide reduction). В ходе этой реакции углекислый газ в присутствии воды разлетается на атомы углерода, кислорода и водорода как бильярдные шары после первого удара. Задача состоит в том, чтобы в итоге собрать необходимые молекулы без образования побочных продуктов. Учёные решали её с помощью получения контроля над поведением молекул воды в растворе. Для этого они игрались с его кислотностью и регулировали электрохимические и электростатические связи молекул.
Наилучший результат был получен в присутствии катализаторов из золота, серебра и платины. Эти металлы наиболее эффективно подавляли реакции образования водорода в процессе электрохимической реакции. Но для массового производства химреактивов и синтетического топлива это не годится — они получатся буквально золотыми. Поиск привёл к катализаторам из обычного цинка, которого в земных недрах более чем достаточно и по бросовой цене.
«На данный момент лучший способ сделать это [преобразовать CO2] электрохимически при комнатной температуре — это использовать драгоценные металлы. Золото и серебро могут немного подавлять реакцию выделения водорода, — поясняют авторы работы. — Благодаря нашему открытию мы теперь можем использовать распространенный на Земле металл цинк, потому что у нас теперь есть отдельный способ контроля воды».
